| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2007年12月17日 |
上皮細胞は隣り合う細胞と接着し、一層の細胞シートをつくっている。この細胞接着を担っているのは、カドヘリンと呼ばれる膜貫通タンパク質だ。カドヘリンは細胞外で他のカドヘリンと結合し、細胞同士を結びつけている。その接着面は細胞を一周する帯のように観察され、「接着ベルト」と呼ばれる。また、カドヘリンは細胞内でカテニン分子と結合し、複合体を形成している。このカドヘリン‐カテニン複合体はアクチン骨格に結合し、接着構造を安定化すると言われてきた。ところが最近、カドヘリン‐カテニン複合体はアクチン骨格と直接結合しているわけではない、という新しいモデルが提唱されていた。 理研CDBの安部健太郎研究員(高次構造形成研究グループ、竹市雅俊グループディレクター)らは培養細胞をモデルにした研究で、EPLIN(Epithelial Protein Lost In Neoplasm)と呼ばれるタンパク質が、カドヘリン‐カテニン複合体とアクチン骨格を結び付けていることを明らかにした。この研究はPNAS (Proceedings of the National Academy of Sciences)誌に12月14日付けでオンライン先行発表された。
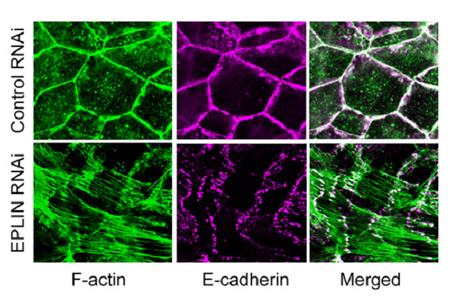
2005年に、カドヘリン‐カテニン複合体とアクチン骨格の間に直接的な結合はない、と発表されて以来、安部らはその間を埋める分子を探し続けてきた。まず、カテニン分子の一つ、αカテニンに結合する分子のスクリーニングを行った。すると、EPLINと呼ばれるアクチン結合分子が浮かび上がり、続く実験で、EPLINのN末端およびC末端ドメイン、αカテニンのVH3-Cドメインが両者の結合に必要であることがわかった。また、EPLINの上皮細胞内における局在を調べると、細胞接着面に局在するカドヘリンとカテニン、Fアクチンと綺麗に重なることが明らかとなった。 次に、彼らがEPLINのノックダウン実験を行ったところ、接着ベルトの形成阻害やカドヘリンの分布異常など、さまざまな変化が観察された。興味深いことに、細胞接着に関わらないアクチンの局在に変化はなかったが、カドヘリンの細胞接着面における分布は不連続となり、これに向けてFアクチンが放射状に分布するように変化した。 EPLINはFアクチンの脱重合を阻害することが知られるため、接着ベルトにおいても同様の機能を果たしているか否かを調べた。その結果、EPLINは確かにFアクチンの安定化に働いており、その作用がαカテニンに依存しているわけではなかった。しかし、EPLINがカドヘリン‐カテニン複合体と結合することで、接着ベルトのFアクチンを安定化していることが示された。さらに彼らは、合成したカドヘリン‐カテニン複合体にEPLIN分子を加えることで、2005年にその存在が疑問視された、カドヘリンとアクチン骨格との接続を試験管内で再合成することに成功した。 彼らの実験は、EPLINがカドヘリン‐カテニン複合体とアクチン骨格を直接的につなぐ分子であることを初めて明らかにした。竹市グループディレクターは、「カドヘリンとFアクチンの相互作用は以前から言われてきましたが、近年それを疑問視する研究が発表されました。しかし今回の結果は、やはりカドヘリンは、Fアクチンと相互作用していることを示しています。その相互作用を仲介する分子を示せたことで、一つの決着がついたのではないかと思います」とコメントし、次のように続ける。「ただし、EPLIN欠損細胞においてもカドヘリンとアクチンの共局在がみられ、他にも仲介分子が存在することを示唆しています。全容解明にはもう少し時間がかかりそうです」。 |
|||||
|
|||||
[ お問合せ:独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター 広報国際化室 ] |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |