| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
2012年12月3日 |
細胞骨格の一種である微小管には2つの顔がある。1つは、細胞分裂の際に中心体に結合して、染色体を左右に引っ張る、染色体の「分裂装置」としての役割。そしてもう1つは、細胞分裂休止期の細胞質に分布し、細胞の形状維持や細胞内小器官輸送等に機能する、細胞の「骨組み」としての役割だ。休止期の微小管の生成機構は複数あり、そのバランスは細胞の種類によって大きく異なる。例えば、線維芽細胞では微小管の大部分は中心体から重合して放射状の構造をとるが、神経細胞や上皮細胞では中心体以外からも重合がおき、放射状の微小管は少ない。休止期において、これら2つの異なる微小管の分布はどのようにして決定され、維持されるのだろうか。 理研CDBの田中慶利リサーチアソシエイト(高次構造形成研究グループ、竹市雅俊グループディレクター)らは、培養細胞を用いた研究から、CAMSAP-2およびCAMSAP-3が協調して、細胞質に分布する微小管の制御と維持に機能することを明らかにした。この成果は、アメリカの科学誌Proceedings of the National Academy of Science USA電子版にて11月19日公開された。
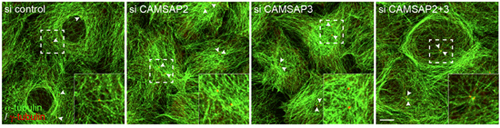
微小管には方向性がある。伸長反応が活発に起こるのがプラス(+)端、その逆がマイナス(−)端だ。微小管は−端側で中心体と結合して放射状に伸長することが一般によく知られており、これまでに、微小管伸長を支える中心体成分が多数同定されてきた。一方、それ以外の微小管は、−端が中心体に結合することなく安定化した状態で細胞質に分布するが、その仕組みについてはほとんど明らかになっていなかった。彼らが注目したのは、CAMSAPという分子だ。高次構造形成研究グループによる以前の研究から、CAMSAP-3(別名Nezha)が微小管の−端側に結合することが分かっていた。そこで、類似分子CAMSAP-2と共に、これらの分子が上皮細胞の微小管の制御にどのように関わっているかを探った。 はじめに、2つのCAMSAP分子の細胞内局在を調べた。CAMSAP-2、CAMSAP-3は両者が集まって小さなクラスターを形成しており、そのクラスターは細胞質全体に分散していた。微小管と共に染色すると、このクラスターは微小管の−端側に局在していた。両者の局在は完全に一致しているわけではなかったが、免疫沈降法により、両分子が相互作用している可能性が示唆された。 では、これらはどのような機能を担っているのか。CAMSAP-2、CAMSAP-3と共に微小管+端因子EB1の細胞内での挙動を解析すると、CAMSAP分子のクラスターからEB1が放出される様子が観察された。EB1は微小管の+端に結合してその伸長に寄与することが知られている。それぞれのCAMSAP特異的なsiRNAを用いてノックダウンを試みたところ、どちらか一方のCAMSAPを欠損させるとEB1の放出量が減少し、2つ同時に欠損させるとEB1放出量の減少はより顕著になった。このことから、CAMSAPは、微小管の安定的な伸長の維持に機能していると考えられた。 通常、上皮細胞では、中心体からの微小管重合はほとんど見られない。しかし、CAMSAPを単一で欠損させると中心体の周りに微小管が集まるようになり、さらに両方を同時に欠損させると−端を中心体に結合した放射状の構造が形成された。CAMSAPは中心体の微小管重合活性を抑制し、上皮細胞に特異的な微小管の分布に寄与しているのだ。また、CAMSAPの欠損細胞では微小管を構成するチューブリンの翻訳後修飾のパターンが変化しており、このような変化が微小管の動態に影響を及ぼしている可能性も示唆された。 さらに、CAMSAPから伸長する微小管は、細胞内小器官の適切な配置にも機能していることが明らかになった。CAMSAP欠損細胞における細胞内小器官の分布を調べると、通常は細胞質中に散在する初期エンドソームが中心体付近に集積した。また、核付近にクラスターを形成しているはずのゴルジ体は、クラスターが分散して細胞質全体に散在していた。 今回の研究から、上皮細胞において、CAMSAP-2とCAMSAP-3は微小管−端にクラスターを形成し、共に、細胞質に分布する「骨組み」としての微小管の形成と維持に重要な役割を担うことが明らかになった。さらに、微小管の分布を介して細胞内小器官の適切な配置にも機能していることが分かった。「今回の研究では、一つ一つの細胞を観察するため、低密度で培養した細胞を用いましたが、実際の生体内における上皮組織は細胞が敷石状に並び、それぞれの細胞が頂端部―底部という極性を形成しています。そして、この極性上皮細胞の微小管の配向には、方向性があることが知られています。」と竹市グループディレクターは話す。「極性上皮細胞では、微小管−端は頂端側に向いています。CAMSAPがこの方向性を制御しているのではないか、また生体内でCAMSAPが欠損するとどのようなことが起こるのか、今後も引き続き解析していきます。」
|
|||||||||||||
 |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |