| 独立行政法人理化学研究所 発生・再生科学総合研究センター |
2013年10月1日 |
細胞骨格としての役割や細胞内物質輸送のレール役として知られる微小管だが、実は2種類ある。中心体から重合する微小管と、そうでない微小管だ。そうでない微小管も中心体の代わりに何らかの分子を核として形成されるはずである。しかし、そもそもこれら2種類の微小管が機能的にどう異なるのか、まだ明らかになっていない。 理研CDBの長江成典研究員(高次構造形成研究グループ、竹市雅俊グループディレクター)らは、中心体に結合しない微小管がアクチン線維を調節し、細胞形態に影響を与えていることを明らかにした。この研究結果はGenes to Cells 誌の5月号に掲載されている。長江研究員は京都大学大学院在籍中に連携大学院制度を利用して理研CDBでこの研究を行った。
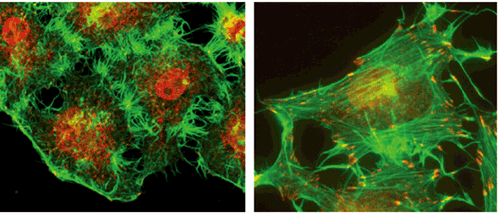
中心体に結合していない微小管の場合、その核となる分子として CAMSAPと呼ばれるタンパク質が最近同定された。研究グループは、CAMSAPが微小管のマイナス端に結合して微小管を安定化することや、微小管の分布を介して細胞内小器官の配置に関与していることを明らかにしていた(科学ニュース 2012.12.3)。今回長江らは、HeLa細胞(ヒト子宮頸癌由来の培養細胞)を用いて、CAMSAPに結合する微小管の機能をさらに解析した。 彼らはCAMSAP3(別名Nezha)に着目し、HeLa細胞における発現を調べると、細胞質全体でドット状に発現し、微小管のマイナス端に結合していることが確認された。これらのドットから微小管のプラス端が伸長していく様子も観察された。そこで、RNAi法によってCAMSAP3を発現抑制する実験を行った。すると、通常は滑らかな細胞の辺縁部から突起が生じ、トゲトゲ状の細胞形態に変化した。また、この時の微小管の様子を調べると、中心体から放射状に広がる微小管が増加していた。 細胞形態の変化の原因を探るために、別の細胞骨格であるアクチン線維の状態も調べた。すると、CAMSAP3を抑制した場合は、細胞形態に関わるアクチンストレスファイバーが増加していることが明らかになった。 しかし、微小管の変化がどのようにしてアクチン線維の状態に影響するのだろうか。彼らはこの疑問に答えるために、アクチンストレスファイバーの形成を誘導するRhoAに着目して一連の実験を行い、次のようなメカニズムを明らかにした。まず、CAMSAP3の発現が低下すると、どういうわけか脱チロシン化された微小管が増える(中心体結合型の微小管の方が脱チロシン化の度合いが高いことが予想される)。すると、Rho活性化因子であるGEF-H1が微小管に結合できずにフリーになり、RhoAを活性化する。その結果、アクチンストレスファイバーの形成が促進され、細胞形態が変化するという仕組みだ。つまり、通常の状態では、CAMSAP3結合型の微小管によってRhoAの活性が抑制され、アクチンストレスファイバーの形成が一定程度に調節されているのだ。 これまで、一つの細胞中に存在する中心体結合型の微小管とそうでない微小管の機能は、あまり区別されることはなかったが、今回の結果はそれらの微小管が異なる機能を持つことを示している。今回見られたCAMSAP3の抑制に伴うHeLa細胞の変化は、上皮様の細胞が線維芽細胞様に変化していることを示唆していた。竹市グループディレクターは、「2つの微小管のバランスがアクチン線維の状態を調節し、細胞タイプに応じた細胞形態を決めている可能性があります。2つの微小管を区別することで、微小管の新たな機能が見えてくることを期待しています」と語った。
|
|||||||||||||||||
 |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |